La majorité des horticulteurs savent combien il est important d’appliquer les bonnes quantités de macronutriments et d’oligoéléments aux cultures; ils savent aussi que plusieurs méthodes existent pour déterminer si une plante souffre d’une carence quelconque. Cependant, certaines carences – ou surplus à l’occasion – ne sont pas provoquées par le manque de l’élément en question, mais plutôt par une mauvaise combinaison avec d’autres nutriments, soit dans le mélange de rempotage, soit dans la plante, parfois dans les deux. Cet article traite de l’importance de l’interaction entre les nutriments et de leurs répercussions sur la culture finale.
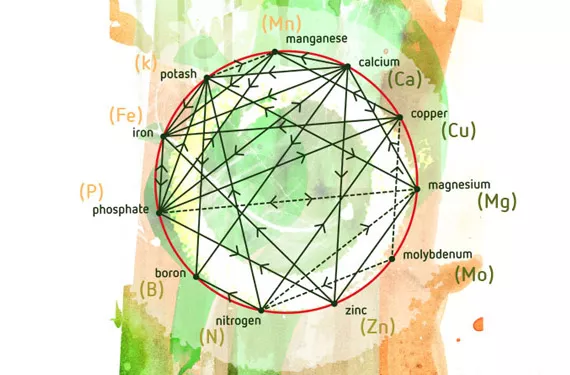
En 1953, D. Mulder a publié "Les éléments mineurs en culture fruitière", une des premières études portant sur l’interaction des nutriments. Dans le cadre de cette étude, il a introduit un graphique qui est encore largement utilisé de nos jours. Au fil des années, d’autres chercheurs y ont ajouté des synergies et des antagonismes possibles. L’étude des interactions entre les nutriments est inévitablement essentielle pour améliorer le rendement des cultures.
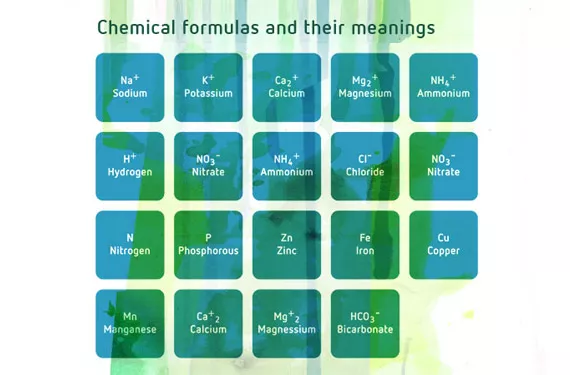
Les proportions relatives de nutriments se répercutent directement sur la nutrition de la plante, mais également sur le substrat dans lequel elle pousse. Les cations (éléments chargés positivement) sont plus ou moins retenus par les charges négatives de certains composants du sol, comme l’argile et les matières organiques. Les cations regroupent entre autres Na+, K+, Ca2+, Mg2+, NH4+ et H+(sodium, potassium, calcium, magnésium, ammonium et hydrogène).
Les plantes absorbent les éléments qui sont dissous dans l’eau, c’est-à-dire que les éléments emprisonnés dans le sol ne peuvent pas être assimilés directement. Dans certains cas, toutefois, ces éléments peuvent s’infiltrer dans l’eau du substrat, les rendant ainsi assimilables par la plante.
Plus le sol ou le substrat peut contenir de cations, plus sa capacité d’échange cationique (CEC) est élevée. La proportion de cations dans le sol influence directement la texture du sol ou du substrat.
Voici certaines des plus importantes interactions entre nutriments.
Azote

Sous forme d’ammonium, NH4+, l’azote nuit à l’assimilation du calcium, du magnésium et du potassium par la plante, surtout lorsque le rapport NO3- (nitrate)/NH4+ (ammonium) est faible.
Conséquemment, un surplus de NH4+ peut entraîner une carence de l’un ou l’autre de ces éléments. Ce problème se produit couramment en culture hydroponique, car on utilise normalement un support de croissance inerte avec un indice de CEC faible ou nul; ici, la quantité de calcium, de magnésium et de potassium disponible dépend entièrement du contenu de la solution nutritive, contrairement aux autres types de sols ou de substrats avec une CEC élevée qui indique généralement une haute teneur en nutriments.
On constate également une interaction antagoniste entre les anions Cl- et NO3-. Un surplus de Cl- (très fréquent dans l’eau saline et/ou sodique) peut nuire à l’absorption de NO3- par la plante.
Le rapport N/K est aussi très important lorsque les plantes passent du stade de croissance (végétatif) au stade de floraison ou de fructification (génératif). La photopériode, c’est-à-dire le nombre d’heures consécutives de noirceur, représente le principal stimulus qui permet aux plantes à jour court ou à jour long de passer du stade végétatif au stade génératif. Toutefois, d’autres stimuli, comme le rapport N/K, influencent aussi d’une certaine manière ces conditions phénologiques.
Les fruits sont remplis de potassium, c’est pourquoi il faut absolument assurer un bon apport en potassium lors de la période générative. Pourtant, quelle que soit la quantité de potassium, si le rapport avec l’azote est trop faible, la formation de fleurs risque d’être réduite. On peut donc se retrouver avec une plante ayant produit plusieurs parties végétatives (feuilles et branches), mais peu de parties génératives (fleurs et fruits).
Potassium

La proportion de potassium doit nécessairement être adéquate, car celui-ci interagit avec le phosphore, le sodium, le calcium et le magnésium, tant dans le sol qu’à l’intérieur de la plante.
Dans les sols argileux avec une CEC élevée, lorsque la plante est irriguée à l’aide d’une solution fertilisante dans laquelle le potassium est dissous dans sa forme ionique, une partie du potassium est alors absorbée par les minéraux et les parties humiques du sol.
Si vous irriguez avec une solution faible en potassium, le potassium contenu dans le sol sera relâché pour être assimilé par la plante. Ensemble, le potassium échangeable et le potassium présent dans la solution se nomment "potassium disponible". Comme le suggère le nom, cette forme de potassium est immédiatement assimilable par la plante.
Toutefois, le potassium existe aussi en forme non échangeable, c’est-à-dire qu’il est bien fixé aux composants du sol. Dans ce cas-ci, le potassium n’est pas directement disponible pour la plante. Il pénètre la solution uniquement lorsque le niveau de potassium échangeable est très bas. Utiliser ce potassium pose un problème, car le processus lui permettant de passer de son état fixé à son état interchangeable prend du temps, la plante doit donc attendre avant de pouvoir l’assimiler.
Appliquer du calcium et du magnésium en trop grande quantité peut provoquer une carence en potassium; les rapports K/Ca et K/Mg doivent toujours être maintenus au-dessus de 2 (mais en dessous de 10, car trop de K peut nuire à l’absorption du calcium et du magnésium). Une trop grande quantité de potassium peut aussi empêcher l’absorption de certains oligoéléments comme le zinc. Il est particulièrement important de prendre en considération cette interaction lorsque l’on utilise de l’eau très dure avec une teneur élevée en calcium et en magnésium.
Phosphore

Les surplus de phosphore perturbent la majorité des oligoéléments (Fe, Mn, Zn et Cu). Dans certains cas, des précipités insolubles se forment, alors que dans d’autres cas, les processus métaboliques de la plante empêchent le transfert des nutriments des racines vers les autres parties de la plante. C’est notamment ce qui se produit avec l’interaction entre P/Zn. L’interaction entre P/Fe semble provoquer des dérèglements au niveau cellulaire et former des complexes insolubles. L’interaction entre P/Cu entraîne généralement la formation de précipités dans la zone racinaire.
Le résultat des interactions entre les éléments peut varier d’une espèce à l’autre et même d’une variété de la même espèce à une autre. Par exemple, chez certaines espèces, la quantité de phosphore disponible semble influencer positivement le niveau de résistance de la plante à la salinité. Par conséquent, une hausse de phosphore permet d’augmenter la résistance de la plante. En revanche, d’autres études en sont venues à des conclusions inverses.
On rapporte également une baisse de la disponibilité de soufre et de calcium lorsque de grandes quantités de phosphate sont appliquées. Dans le cas du calcium, ceci est provoqué par la formation de phosphates insolubles.
À l’inverse, le phosphore favorise l’absorption du magnésium, donc une carence en phosphore aurait tendance à entraîner une carence en magnésium si ce dernier est présent en petite quantité.
Le NO3- et le NH4+ facilitent tous deux l’absorption du phosphore. Dans le cas du NH4+, le phénomène s’expliquerait par l’excrétion d’ions H+ par la plante lorsque l’azote est administré en grande quantité sous cette forme. Les ions H+ provoquent une acidification légère dans la zone racinaire, ce qui favorise la solubilité de certains sels de phosphore qui autrement demeureraient emprisonnés ou dans une forme insoluble.
Magnésium

Le rapport Ca/Mg doit également être pris en considération. Ceci influence surtout la structure du sol. Le calcium dans le sol tend à améliorer l’aération alors que le magnésium favorise l’adhésion des particules dans le sol. Ainsi, si le rapport Ca/Mg est très faible, c’est-à-dire que le complexe d’échange est occupé en majorité par les ions de Mg, le sol devient moins perméable ce qui nuit au développement des cultures. Pour cette raison, le rapport Ca/Mg doit toujours être supérieur à 1.
Établir un rapport adéquat entre les éléments contribue aussi à l’équilibre minéral à l’intérieur de la plante. Le rapport Ca/Mg dans les feuilles de certaines plantes est d’environ 2:1, ce qui signifie qu’il est nécessaire d’ajouter plus de calcium que de magnésium dans la solution nutritive.
L’assimilation du magnésium est aussi influencée par les niveaux de Zn et de Mn dans le support de croissance. En plus d’être toxique, une surdose de ces deux oligoéléments pourrait réduire le pouvoir d’absorption de la plante.
Interaction du sodium avec le calcium, le magnésium et le potassium
Le sodium a un effet néfaste sur la plupart des plantes parce qu’il devient toxique lorsqu’il s’accumule dans certains tissus de la plante et parce qu’il a la capacité d’endommager la structure du sol en faisant concurrence aux autres cations pour l’absorption (l’adhésion du cation à la surface de certains composants du sol).
Lorsque le sol contient un niveau de sodium potentiellement nuisible pour la culture, on dit alors qu’il est sodique. La sodicité du sol ne doit pas être confondue avec la salinité du sol, qui elle se réfère à la quantité totale de sels dans le sol, sans toutefois préciser les sels qui prédominent.
Il existe deux méthodes pour déterminer les risques de dommages provoqués par une surdose de sodium. La première consiste à calculer le rapport entre le sodium et les autres cations dissous qui seront absorbés par la plante. C’est ce que l’on appelle le rapport d’absorption du sodium (sodium absorption ration SAR). Le SAR se définit par l’équation suivante:
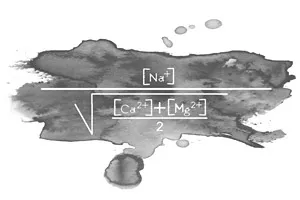
L’eau d’irrigation ayant un SAR de plus de 18 est considérée comme ayant une haute teneur en sodium.
L’autre méthode utilisée consiste à calculer la proportion de cations de sodium retenue dans le complexe d’échange comparativement aux autres. C’est ce que l’on appelle le pourcentage de sodium échangeable (PSC).
PSC = 100 x Na / CEC
Un sol est considéré comme sodique s’il affiche un PSC supérieur à 15%.
Finalement, le rapport entre le calcium, le magnésium et le sodium peut être altéré par la présence de carbonates et de bicarbonates.
En d’autres termes, même si au départ la teneur en Ca et en Mg est plus élevée que la teneur en Na – ce qui représente en principe un bon rapport pour éviter les problèmes – en irriguant avec de l’eau très dure contenant beaucoup de carbonate et de bicarbonates, le calcium et le magnésium risquent de se précipiter sous forme de carbonates insolubles, renversant l’équilibre en faveur du sodium et augmentant ainsi le rapport d’absorption du sodium.
C’est ce que l’on appelle l’indice de carbonate de sodium résiduel (CSR). La formule est la suivante:
CSR=(CO3-+HCO3-)-(Ca+2+Mg+2)
L’eau de robinet avec une valeur dépassant 2,5 ne doit pas être utilisée, car elle risque d’entraîner des problèmes.